Změna vzhledu obalů vakcín Imovax Polio, Verorab, Typhim Vi, Stamaril, Avaxim, Adacel, Tetraxim a Adacel Polio
SÚKL informuje o novém vzhledu obalů léčivých přípravků Imovax Polio, inj.sus.isp., Verorab, inj.psu.lqf., Typhim Vi, inj.sus.isp., Stamaril, inj.plq.sus.isp., Avaxim, inj.sus.isp., Adacel, inj.sus.isp., Tetraxim inj.sus.isp. a Adacel Polio inj.sus.isp.
Státní ústav pro kontrolu léčiv schválil změny registrace, kterými držitel rozhodnutí o registraci Sanofi Pasteur, Lyon, Francie mění obaly níže uvedených léčivých přípravků:
| Název | Léková forma | Registrační číslo | SÚKL kódy |
| IMOVAX POLIO | injekční suspenze v předplněné injekční stříkačce | 59/855/92-C | 100224, 100225, 115258 |
| VERORAB | prášek a rozpouštědlo pro injekční suspenzi | 59/123/90-C | 231922, 107496, 151282 |
| TYPHIM VI | injekční suspenze v předplněné injekční stříkačce | 59/109/01-C | 85170 |
| STAMARIL | prášek a rozpouštědlo pro injekční suspenzi v předplněné injekční stříkačce | 59/068/99-C | 103543, 103545, 103547, 125353, 125354, 125355, 125356, 125357, 125358 |
| AVAXIM | injekční suspenze v předplněné injekční stříkačce | 59/916/97-C | 107133 |
| ADACEL | injekční suspenze v předplněné injekční stříkačce | 59/158/10-C | 211810, 211811, 211812, 211813, 211814, 211815 |
| TETRAXIM | injekční suspenze v předplněné injekční stříkačce | 59/285/16-C | 133803, 133804, 133805, 133806, 133807 |
| ADACEL POLIO | injekční suspenze v předplněné injekční stříkačce | 59/265/19-C | 244238, 244239, 244240, 244241, 244242, 244243, 244244 |
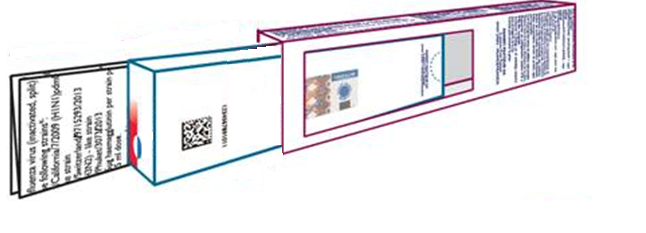
Vnější obal těchto léčivých přípravků je nově složen ze dvou vrstev. První vrstva vnějšího obalu (vnitřní část) je tvořena krabičkou, na které je text v angličtině a španělštině. Na této krabičce je uveden rovněž jedinečný identifikátor ve formě 2D kódu spolu s daty čitelnými okem (PC, SN, EXP, LOT), vnitřní krabička je také opatřena prostředkem k ověření manipulace s obalem (tzv. ATD) ve formě perforace.
Druhá vrstva vnějšího obalu (vnější část) je tvořena přebalem bez bočních stran, na kterém je text v češtině. V této druhé vrstvě je vyříznuta část balení tak, aby byl čitelný jedinečný identifikátor a data čitelná okem uvedená na první vrstvě obalu. Tato vnější vrstva obalu je na obou stranách opatřena ATD ve formě přelepky.
Text uvedený na první vrstvě v angličtině a španělštině odpovídá informacím uvedeným na druhé vrstvě v českém jazyce.
Příbalová informace v českém jazyce je vložena mezi první a druhou vrstvu vnějšího obalu.
Obaly přípravků splňují požadavky Nařízení Komise v přenesené pravomoci (EU) 2016/161, tzv. delegovaných aktů.
Tyto léčivé přípravky budou v baleních popsaných výše uváděny na trh postupně od března 2019.
Sekce registrací
13. 3. 2019
aktualizace 9. 4. 2021
