Změna registrace léčivého přípravku Letrox tablety
SÚKL informuje zdravotnické pracovníky a pacienty o změně složení pomocných látek, vzhledu a podmínek uchovávání léčivých přípravků Letrox 50 mikrogramů tbl.nob., Letrox 75 mikrogramů tbl.nob., Letrox 100 mikrogramů tbl.nob., Letrox 125 mikrogramů tbl.nob. a Letrox 150 mikrogramů tbl.nob.
Státní ústav pro kontrolu léčiv schválil ke dni 13. 1. 2022 změnu registrace následujících léčivých přípravků:
- Letrox, 50 mikrogramů, tbl.nob., registrační číslo 56/171/83-A/C, SÚKL kód 187424, 187425 a 187426,
- Letrox, 75 mikrogramů tbl.nob., registrační číslo 56/576/07-C, SÚKL kód 184243, 184244 a 184245,
- Letrox, 100 mikrogramů tbl.nob., registrační číslo 56/171/83-B/C, SÚKL kód 187427, 187428 a 187429,
- Letrox, 125 mikrogramů tbl.nob., registrační číslo 56/577/07-C, SÚKL kód 169712, 169713 a 169714,
- Letrox, 150 mikrogramů tbl.nob., registrační číslo 56/204/98-C, SÚKL kód 172043, 172044 a 172045.
V rámci této změny registrace došlo ke změně složení pomocných látek, ke změně vzhledu tablet, obalů a ke změně podmínek uchovávání.
Z dříve
Složení pomocných látek:
Mikrokrystalická celulosa, dihydrát hydrogenfosforečnanu vápenatého, dextrin, sodná sůl karboxymethylškrobu (typ A), částečně vyšší nasycené acylglyceroly.
Vzhled tablety:
Téměř bílé až mírně béžové, kulaté, jemně vypouklé tablety s půlicí rýhou na jedné straně s vyraženým „50“ na druhé straně.
Téměř bílé až mírně béžové, kulaté, jemně vypouklé tablety s půlicí rýhou na jedné straně s vyraženým „75“ na druhé straně.
Téměř bílé až mírně béžové, kulaté, jemně vypouklé tablety s půlicí rýhou na jedné straně s vyraženým „100“ na druhé straně
Téměř bílé až mírně béžové, kulaté, jemně vypouklé tablety s půlicí rýhou na jedné straně s vyraženým „125“ na druhé straně.
Téměř bílé až mírně béžové, kulaté, jemně vypouklé tablety s půlicí rýhou na jedné straně s vyraženým „150“ na druhé straně.
Podmínky uchovávání:
Uchovávejte při teplotě do 25 °C.
Na nyní
Složení pomocných látek:
Mikrokrystalická celulosa, monohydrát cystein-hydrochloridu (částečně přítomný jako cystin), předbobtnalý škrob, kukuřičný škrob, lehký oxid hořečnatý, mastek.
Vzhled tablety:
Bílé až béžové, kulaté, jemně vypouklé tablety s půlicí rýhou na jedné straně.
Podmínky uchovávání:
Uchovávejte při teplotě do 30 °C.
Neočekává se žádná změna bezpečnostního profilu. Léčivou látkou je stále levothyroxin sodný ze stejného výrobního zdroje, došlo pouze ke změně složení pomocných látek, vzhledu a podmínek uchovávání. Způsob užívání a monitorování léčivého přípravku Letrox zůstává nezměněný.
Pro snadné odlišení přípravku Letrox s novým složením od předchozího došlo ke změně vzhledu vnějších obalů a blistrů pro jednotlivé síly přípravku a k přidání textu „Změněné pomocné látky. Čtěte příbalovou informaci.“ na krabičku a „Změněné pomocné látky.“ na blistry:
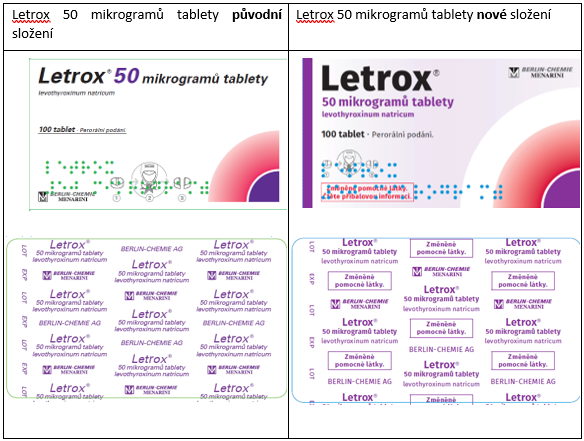
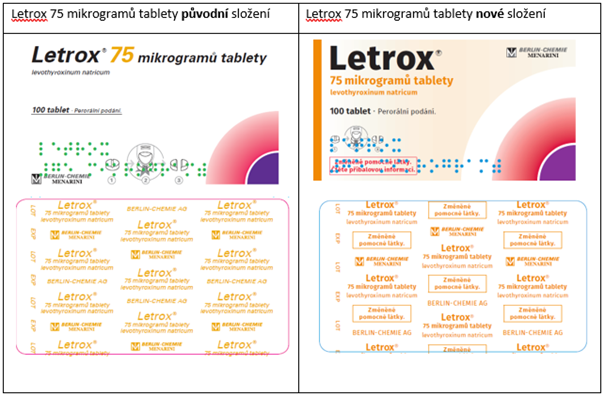
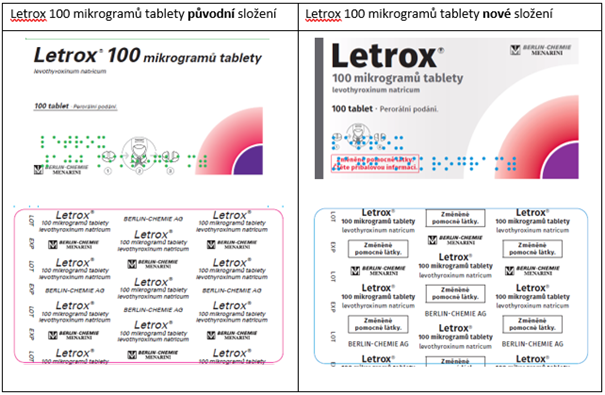
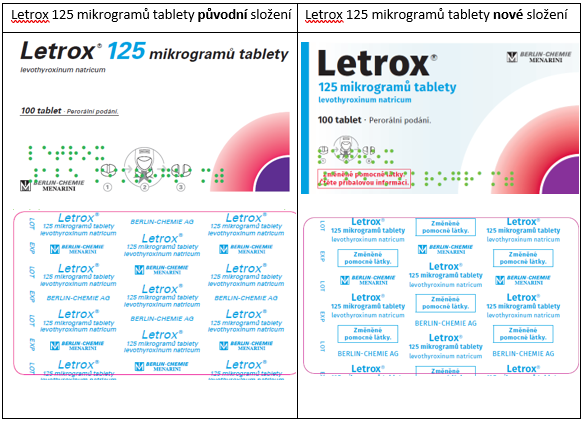
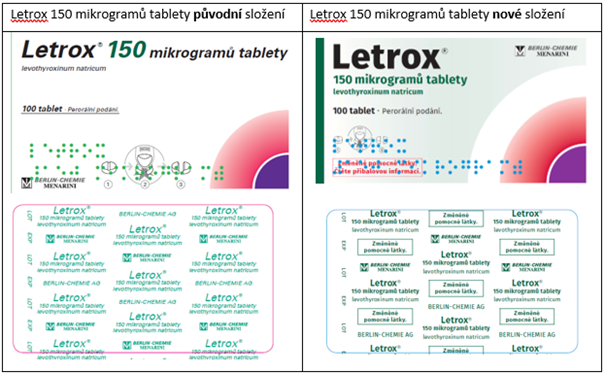
Na trhu v České republice by se měly přípravky se změněným složením objevit v průběhu roku 2022 (květen–září).
Před uvedením přípravků se změněným složením na trh rozešle společnost BERLIN-CHEMIE AG ve spolupráci se Státním ústavem pro kontrolu léčiv Informační dopis zdravotnickým pracovníkům (DHPC) s podrobnějšími údaji o této změně registrace.
Aktualizace 4. 8. 2022: Dle posledních informací od držitele rozhodnutí o registraci by se měly přípravky se změněným složením objevit na trhu v České republice až v rozmezí října – listopadu 2022.
Sekce registrací
21. 1. 2022
