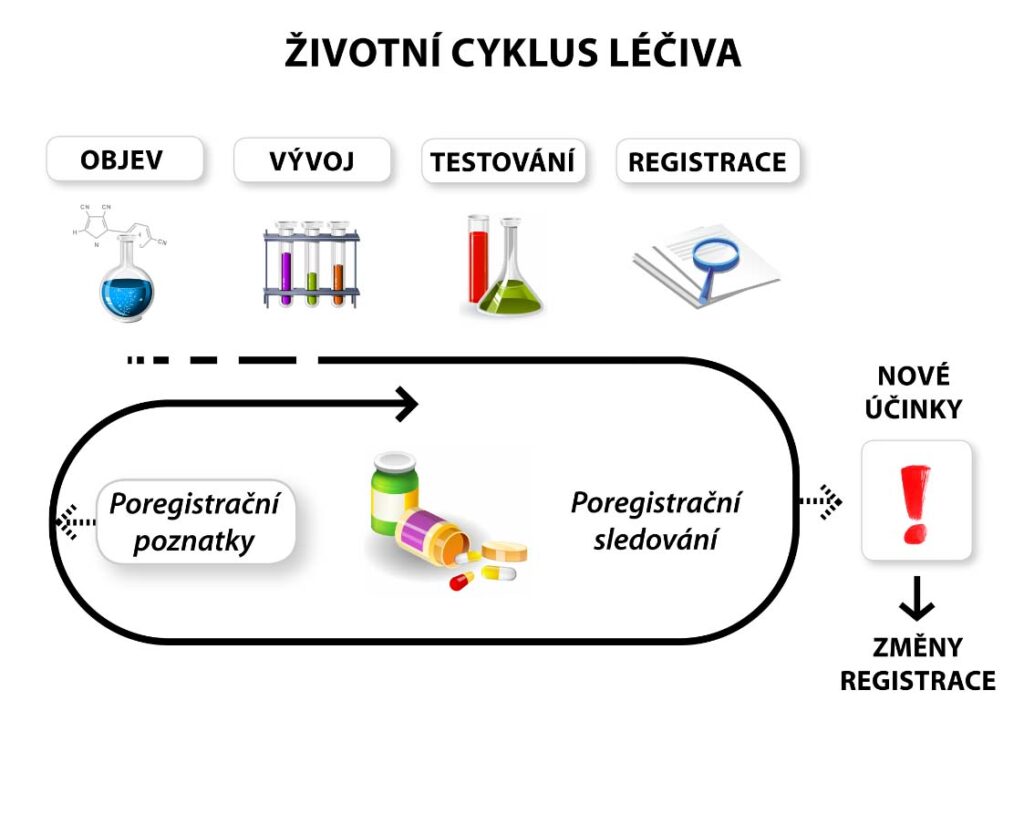
Jaký je životní cyklus léku?
Životní cyklus léku zahrnuje nejen klinické hodnocení a registraci, ale patří sem i sledování jeho kvality, účinnosti a bezpečnosti po celou dobu platnosti jeho registrace, včetně jeho stažení z trhu např. z důvodu závažných nežádoucích účinků, závady v jakosti apod.
Uvedení léku na trh předchází dlouholetý vývoj – klinické hodnocení, které probíhá v několika fázích. Výsledkem klinického hodnocení je stanovení nejvhodnějšího
dávkování pro pacienta, kdy je lék účinný s minimálním rizikem nežádoucích účinků.
Další etapou je registrace léčivého přípravku lékovou agenturou (SÚKL u národních nebo evropských registrací, EMA u centralizovaných registrací), kdy je posuzována dokumentace ke kvalitě, účinnosti a bezpečnosti léčivého přípravku. V rámci registrace jsou posuzovány předložené výsledky klinického hodnocení a další dokumentace vymezená v právních předpisech, týkající se např. kvality léčivých a pomocných látek v daném přípravku, zajištění správné výrobní praxe a další.
Důležité souhrnné informace o léčivém přípravku týkající se jeho kvality, účinnosti a bezpečnosti jsou uvedeny ve schválených informacích o přípravku (tj. v souhrnu údajů o přípravku určeném pro lékaře, v příbalové informaci určené pro pacienty, a v textu na obalu).
Teprve po udělení registrace může být lék uveden na trh. V té chvíli začíná jeho poregistrační sledování v klinické praxi. Sleduje se např. výskyt nežádoucích účinků, interakce s dalšími léky, a hodnotí se i další nově zjištěné skutečnosti, např. ty, které se neprojevily v průběhu klinického hodnocení.
Dle charakteru nově zjištěných informací a jejich závažnosti pro pacienty z hlediska možného rizika ohrožení zdraví se přijmou vhodná opatření. Např. se aktualizují schválené informace o přípravku (cestou změny registrace), v případě výskytu závažných nežádoucích účinků nebo závady v jakosti může být lék stažen z trhu, může dojít k pozastavení či zrušení registrace apod.
Životní cyklus léku jednoduše popisuje i následující obrázek: